前列腺癌目前已跃升为我国男性发病率最高的恶性泌尿生殖系统肿瘤[1]。AR及其下游信号通路在前列腺癌的发生发展中扮演着关键角色。近期多个靶向该通路的关键临床试验的研究进展,也进一步证实了AR重要的临床价值。
睾丸产生的睾酮是男性体内的主要雄性激素,睾酮可以被类固醇5α-还原酶(SRD5A1/2)进一步加工成活性更强的二氢睾酮(DHT)。此外,肾上腺皮质也能生成的脱氢表雄酮(DHEA)也可以在前列腺中转化成睾酮。睾酮和DHT在与雄激素受体(AR,androgen receptor)结合后,可以激活后者。AR属于类固醇激素受体超家族,其编码基因位于染色体Xq12区,包括8个外显子。AR蛋白由四个结构域组成:NH2端转录激活结构域(NTD),中部DNA结合结构域(DBD),C端配体结合结构域(LBD),以及连接DBD和LBD的铰链区(Hinge)。在没有激素时,AR与热休克蛋白结合以非活性形式存在于细胞质中;一旦与雄激素结合后,AR便发生构象转化,形成二聚体进入细胞核,并识别基因组DNA上的雄激素应答元件(AREs),招募共激活因子(如SPOP、FOXA1、SRC1/2/3等),启动靶基因的转录,包括PSA,跨膜丝氨酸蛋白酶(TMPRSS2)等[2]。
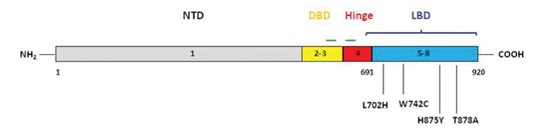
(图片来源:Watson PA, Arora VK, Sawyers CL. Nat Rev Cancer. 2015 Dec;15(12):701-11.)
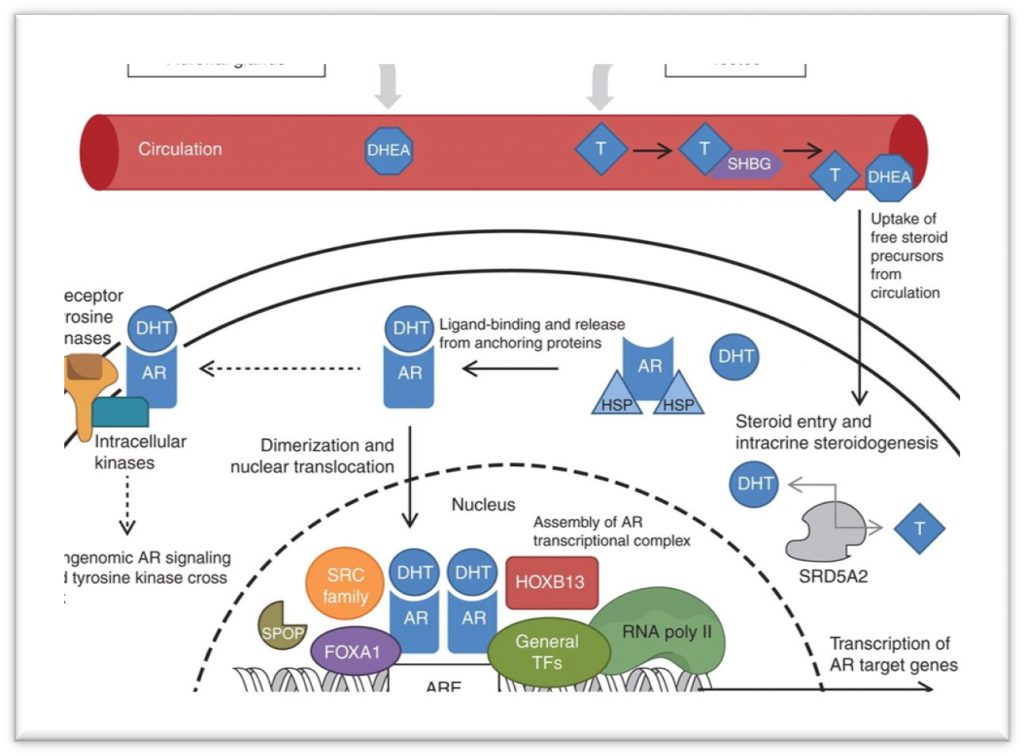 (图片来源:Dai C, Heemers H, Sharifi N. Cold Spring Harb Perspect Med. 2017 Sep 1;7(9):a030452.)
(图片来源:Dai C, Heemers H, Sharifi N. Cold Spring Harb Perspect Med. 2017 Sep 1;7(9):a030452.)
自从1941年科学家们发现转移性前列腺癌患者可以从手术去势中获益时,雄激素剥夺治疗(androgen deprivation therapy,ADT) 便逐渐成为局部晚期前列腺癌和转移性前列腺癌的基石。出于患者顺应性的考虑,以促性腺激素释放激素(GnRH)激动剂/拮抗剂为代表的药物去势逐渐取代了外科手术去势治疗。此外,其他靶向AR信号通路的药物治疗方案还包括雄激素受体抑制剂(ARI),CYP17酶抑制剂等。然而多数患者经过中位2-3年的ADT治疗后,疾病会进展为去势抵抗性前列腺癌(CRPC)[3]。尽管FDA已经批准新型内分泌药物第二代ARI恩杂鲁胺和CYP17酶抑制剂阿比特龙用于既往接受过或未接受过化疗的转移性CRPC(mCRPC)患者,但是mCRPC患者的中位生存时间一般仅为16-18个月[4],预后依旧很差。
目前在前列腺癌中,已获FDA批准或已经开展临床试验的非ADT疗法的药物及其靶点如下图所示。在靶向AR信号通路的药物中,ARV-110(bavdegalutamide)是Arvinas公司开发的一种口服的、选择性靶向并降解AR的PROTAC蛋白降解剂;临床前研究显示其对AR基因的常见耐药点突变T878A、H875Y、F877L和M895V有效。Arvinas最近公布了ARV-110单药在I/II期临床研究(NCT03888612)中的良好表现:在46%的携带AR H875Y和/或T878X突变的mCRPC患者(n=28)中观察到PSA下降≥50%。这些患者入组前接受过1-2线ARI或阿比特龙治疗以及不超过两种化疗方案。目前正在开展ARV-110联合阿比特龙在阿比特龙治疗后生化进展的患者中的Ib期临床研究。
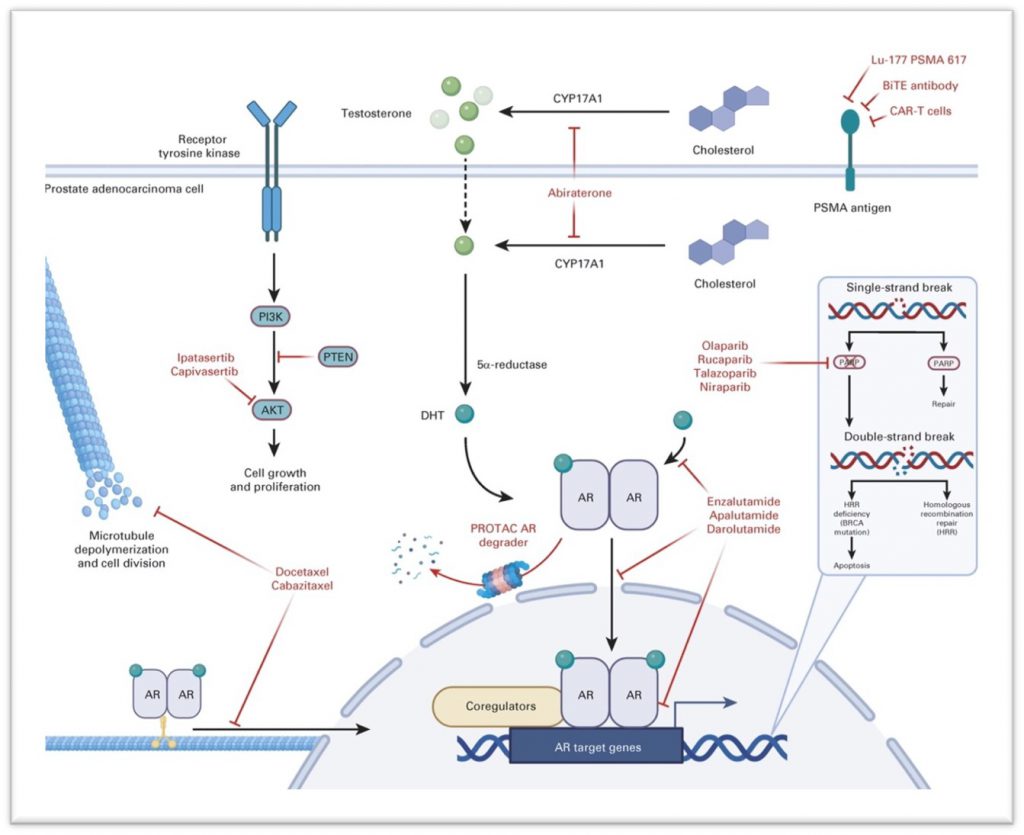
(图片来源:Sayegh N, Swami U, Agarwal N. JCO Oncol Pract. 2022 Jan;18(1):45-55.)
慧渡医疗是一家专注于液态活检的基因检测公司,其针对外周血开发的伴随诊断产品的卓越技术优势,不仅可以更好地帮助肿瘤患者实现个性化用药,同时也可以推动药企临床试验的开展。慧渡医疗与国际知名肿瘤研究机构在前列腺癌中已经开展过多项研究合作,其中两项研究的成果发表在知名泌尿系统肿瘤杂志European Urology上。此外,慧渡医疗基于ctDNA开发的MRD检测产品也与上海仁济医院、梅奥诊所等知名机构在泌尿系统肿瘤中开展了多项合作研究,为新一代液态活检技术服务全球肿瘤患者打下了坚实的基础。
参考文献:
[1] Rongshou Zheng, Siwei Zhang, Hongmei Zeng, et al. Cancer incidence and mortality in China, 2016. Journal of the National Cancer Center, 2022, https://doi.org/10.1016/j.jncc. 2022.02.002. [2] Dai C, Heemers H, Sharifi N. Androgen Signaling in Prostate Cancer. Cold Spring Harb Perspect Med. 2017 Sep 1;7(9): a030452. [3] Harris WP, Mostaghel EA, Nelson PS, et al. Androgen deprivation therapy: progress in understanding mechanisms of resistance and optimizing androgen depletion. Nat Clin Pract Urol. 2009; 6: 76–85. [4] Marques RB, Dits NF, Erkens-Schulze S, et al. Bypass mechanisms of the androgen receptor pathway in therapy-resistant prostate cancer cell models. PLoS One. 2010; 5: e13500.
