
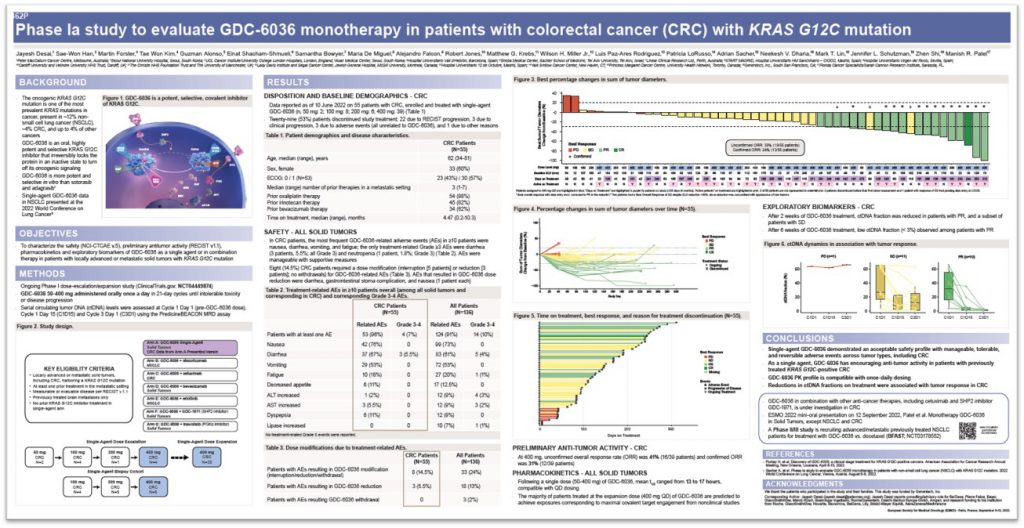
在本次ESMO学术盛会上,慧渡医疗联手国际药企Roche / Genentech发布了PredicineBEACON™新一代个体化MRD检测在KRAS G12C抗肿瘤新药(GDC-6036)一期临床试验中的应用。该研究的亮点是在没有肿瘤组织的情况下,慧渡医疗利用治疗前的血浆作为基线进行癌症基因变异的筛查,在多个时间点对血浆ctDNA进行个体化的MRD连续监测,并在临床一期的研究中发现了患者血浆ctDNA变化与肿瘤对药物疗效的对应关系。
这是继今年年初慧渡医疗在ASCO-GU 2022上发布PredicineBEACON™在膀胱癌免疫新辅助治疗临床试验的研究结果后,再一次获得国际顶尖药企的认可并在临床试验中采用。
合作单位:Roche / Genentech
GDC-6036是一款口服、选择性强的强效KRAS G12C抑制剂,本次发表的临床试验(NCT04449874)是该药物在晚期转移期KRAS G12C阳性CRC患者的一期剂量爬坡 / 扩展研究。
自从首个KRAS G12C抑制剂sotorasib(AMG510,商品名LUMAKRAS)获FDA批准用于既往至少接受过一线系统治疗的携带KRAS G12C突变的局部晚期或转移性NSCLC患者后,GDC-6036可能成为该靶点又一款重磅抗肿瘤药物。在没有肿瘤组织的情况下,该研究使用慧渡医疗的MRD检测产品PredicineBEACON™利用治疗前的血液作为基线进行癌症基因变异的筛查,在多个时间点对血浆ctDNA进行个体化的MRD连续监测,以探究患者ctDNA变化能否作为评价药物疗效的指标。
截至2022年1月28日,43例入组患者分别接受不同剂量的药物治疗:50 mg(2)、100 mg(7)、200 mg(4)和400 mg(30)。入组患者既往接受过1-7线治疗(中位数为3)。入组后的中位治疗时间为2.8个月(0.1-11.2)。安全性方面表现良好,最常见的不良反应包括恶心、腹泻、呕吐、消化不良、疲劳和食欲下降,唯一的≥3级不良反应是腹泻(3,7%)。药代动力学方面:在50-400 mg时的平均半衰期为13-17 h。疗效方面:41例患者的疗效可评估,未经确认的总缓解率为29%(12/41),包括一例完全缓解,经确认的总缓解率达20%(8/41)。
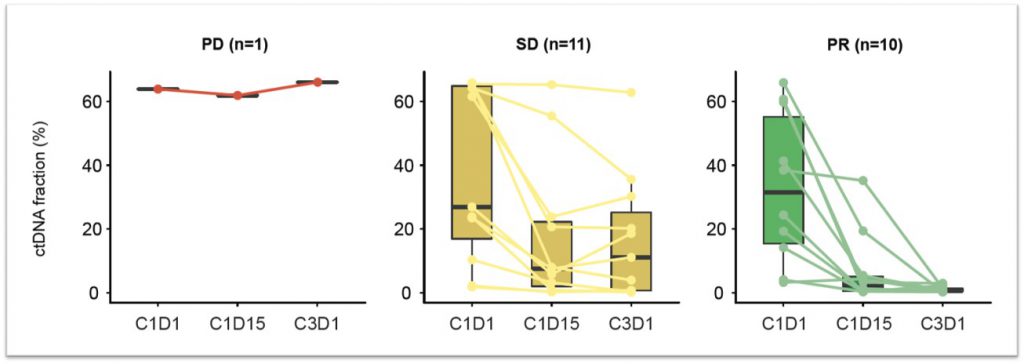
值得注意的是,经由PredicineBEACON™进行动态MRD监测的结果显示,在GDC-6036治疗2周后,在观察到部分缓解的患者和一部分疾病稳定的患者中可检测到MRD信号的降低;治疗6周后,即可观察到MRD信号的显著下降,提示PredicineBEACON™可以评估临床试验患者对药物的响应,并具备通过监测药物疗效成为早期研究替代终点的潜在可能性。
ctDNA应用于药物早期临床开发的应用获得CSCO、FDA、ESMO、FoCR等专家组织的广泛认可,虽然仍有众多亟待解决的问题才可以广泛用于临床实践,但更多临床试验的开展将推进这一进程的标准化和相关管理规范的完善。选择一款性能可靠的ctDNA检测产品是在临床试验中应用和研究ctDNA相关标志物的重要第一步。
PredicineBEACON™是慧渡医疗自主开发的一款可以采用肿瘤组织、血浆或尿液作为基线样本,实现个体化MRD检测的基因检测产品。该产品已经被证实在接受PD-1抑制剂toripalimab新辅助免疫治疗的肌层浸润性膀胱癌患者表现出优秀的预测疗效和复发的性能。PredicineBEACON™目前被多家国际顶尖药企和医院采用,广泛应用于全球新药临床试验和个体化MRD疾病的复发监控。
点击查看往期相关链接:
*ASCO-GU22 | 新一代定制化MRD检测-PredicineBEACON™基于尿液样本评估膀胱癌新辅助免疫治疗的疗效
*ASCO-GU22 | PredicineBEACON™-定制化MRD通过尿液动态监控膀胱癌新辅助免疫治疗
