成纤维细胞生因子受体(FGFR)属于酪氨酸激酶受体(RTK)家族中的一类,主要包括FGFR1、FGFR2、FGFR3、FGFR4和FGFRL1(FGFR5)。FGFR家族的配体众多,目前已知其中18个配体可与FGFRs结合(包括FGF),引起受体二聚化并使酪氨酸激酶结构域发生磷酸化,从而激活下游信号传导通路,如RAS/MAPK、PI3K/AKT及PLC-γ/PKC等,实现对细胞增殖、分化、迁移、组织修复等生理活动的调控[1]。
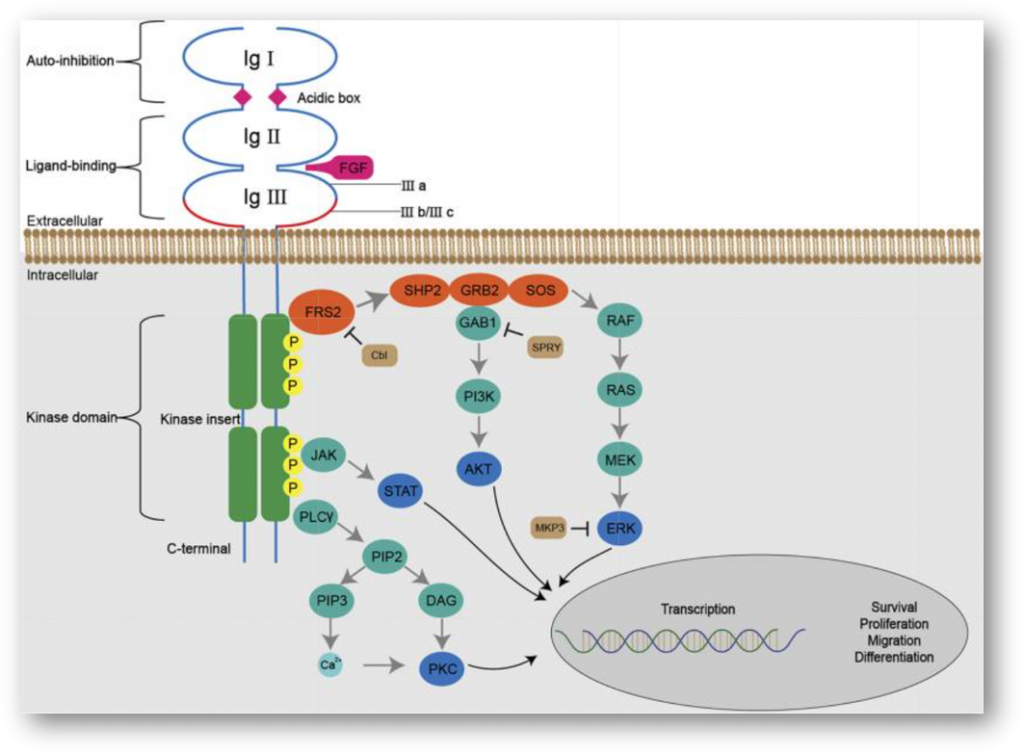
FGFR1/2/3/4在实体瘤中的变异类型包括过表达、基因扩增、点突变和重排(融合)。一项纳入4853例实体瘤患者石蜡切片样本的回顾性研究报道,FGFR1/2/3/4基因变异在实体瘤中的频率约为7.1%,以扩增为主(约占66%),其中以FGFR1基因的变异最常见;FGFR1/4基因以扩增为主,而FGFR2/3基因以重排为主。从肿瘤类型来看,FGFR基因变异在尿路上皮癌(32%)、乳腺癌(18%)、子宫内膜癌(13%)和肺鳞癌(13%)中最常见[2]。目前,已经有多个针对FGFR靶点开发的小分子抑制剂和抗体类药物,其中FGFR抑制剂erdafitinib(Balversa,厄达替尼)、pemigatinib(Pemazyre,佩米替尼)、infigratinib(Truseltiq,英菲替尼)已先后获得FDA批准用于相应适应症。下面,我们来了解其中几款新药的临床试验进展。
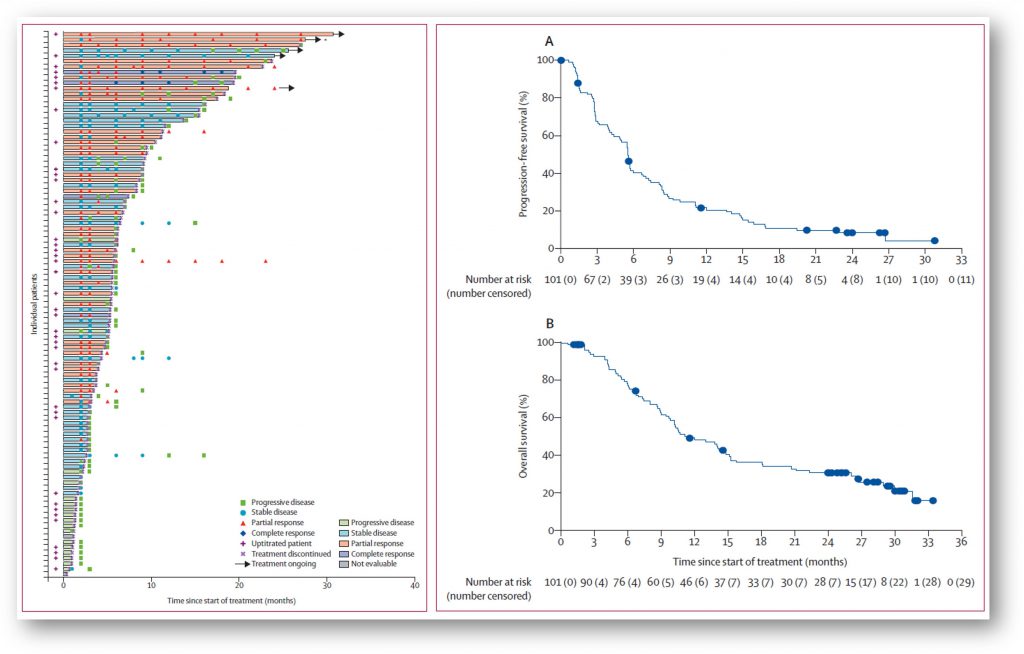
Erdafitinib是杨森制药研发的一款靶向FGFR1/2/3/4的小分子抑制剂;基于BLC2001研究的早期结果,FDA于2019年4月加速批准erdafitinib用于治疗携带有FGFR3或FGFR2基因异常的,既往含铂治疗(包括12个月内新辅助或辅助含铂化疗)失败后疾病进展的局部晚期或转移性膀胱癌成人患者。BLC2001研究(NCT02365597)是一项在既往化疗失败的,携带FGFR3点突变或FGFR2/3基因融合的局部晚期或转移性尿路上皮癌患者中开展的II期临床研究。该研究的最新数据显示,101例晚期FGFR基因突变的膀胱癌患者接受erdafitinib治疗后的客观缓解率为40%、疾病控制率高达80%,中位无进展生存期为5.5个月、中位总生存期11.3个月,两年生存率为31% [3]。目前已经开展多个临床研究,探讨erdafitinib在不同适应症、不同给药方案和给药方式下的安全性和疗效:如FGFR变异的实体瘤(NCT04083976)、联合治疗(NCT04963153)以及膀胱内给药(NCT05316155、NCT05567185)等。杨森制药将在即将召开的2023年ASCO-GU大会上公布NCT05316155的最新进展(Abstract #TPS583)。
Pemigatinib是Incyte公司开发的FGFR1/2/3选择性抑制剂;基于FIGHT-202研究(NCT02924376)的结果,pemigatinib获FDA加速批准用于治疗既往治疗失败的FGFR2融合或重排的不可切除的局部晚期或转移性胆管癌患者。FIGHT-202研究是一项多中心、开放标签的单臂II期临床研究,共纳入了107例FGFR2融合或重排的不可切除的局部晚期或转移性胆管癌患者,其中86%的患者为FGFR2融合阳性,具体疗效结果见下表。2018年12月,信达生物与Incyte公司达成合作,获得佩米替尼在中国大陆、香港、澳门和台湾地区的开发和商业化权利,并已陆续在中国晚期胆管癌中开展了三项临床试验(CTR20201757、CTR20192577和CTR20192515);国家药监局(NMPA)已于2022年3月批准佩米替尼片在国内上市。

Infigratinib是FGFR1/2/3/4的小分子抑制剂;2021年FDA基于CBGJ398X2204研究(NCT02150967)的结果批准其用于治疗既往治疗失败的,携带FGFR2融合或重排的不可切除的局部晚期或转移性胆管癌患者。CBGJ398X2204研究是一项在晚期胆管癌患者中开展的II期单臂研究。该研究共纳入108例至少接受过一线治疗的FGFR2阳性晚期胆管癌患者,具体疗效结果见下表。Infigratinib在一项I期临床研究中表现出对肺鳞癌的初步疗效。该研究纳入了36例FGFR1基因扩增的肺鳞癌患者,疾病控制率为50%,包括4例部分缓解患者和14例疾病稳定的患者[4]。目前已经开展infigratinib在晚期或转移性实体瘤患者中的II期临床研究(NCT04233567)。

ABSK091(AZD4547)是一款和誉医药开发的选择性FGFR1/2/3抑制剂,I期S1400D临床研究曾表明AZD4547在FGFR1扩增的肺鳞癌患者中表现出抗肿瘤活性,但在一项II期临床研究(SWOG S1400D研究)中,AZD4547的疗效并不理想[5]。另一项II期NCI-MATCH研究纳入了48例携带FGFR1-3基因异常的实体瘤患者,在41例疗效可评估的患者中,4例患者达到部分缓解(其中2例携带FGFR2或FGFR3点突变,另2例携带FGFR3融合),另外18例患者疾病稳定;患者的中位无进展期为3.4个月[6]。ABSK061是一款FGFR2/3抑制剂,正在FGFR2/3基因异常的实体瘤中开展早期临床研究(NCT05244551)。ABSK-011则是一款靶向FGFR4(FGF19的受体)的选择性抑制剂,目前正在FGF19高表达的实体瘤患者中开展早期临床研究(NCT04906434、NCT05441475)。
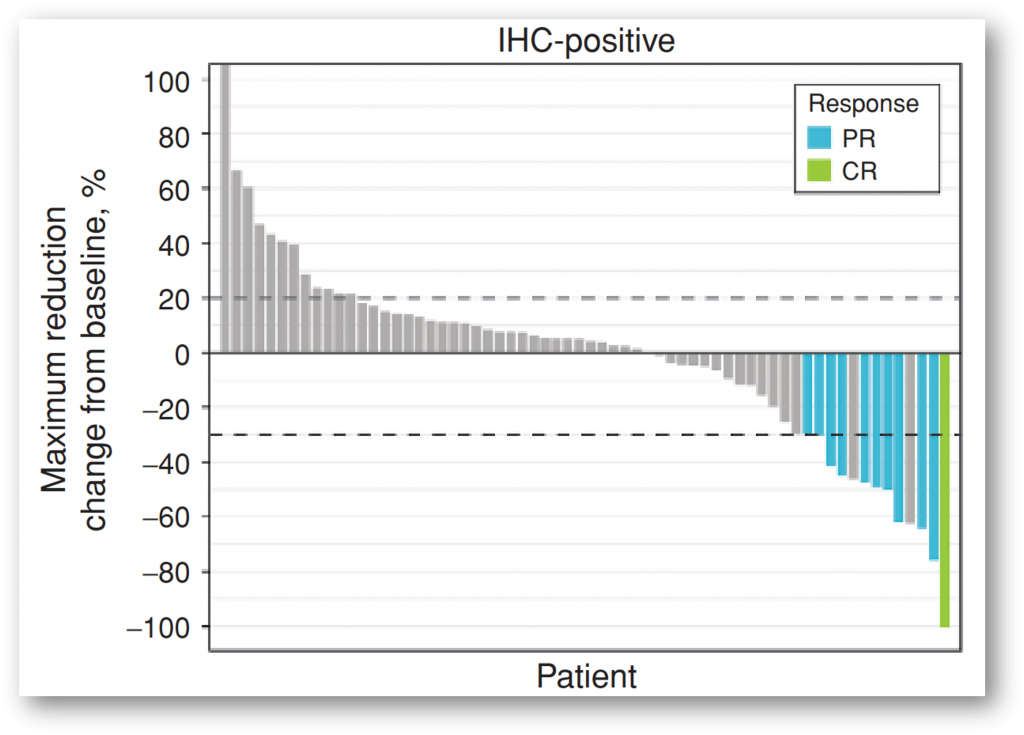
BLU-554(fisogatinib)是一种FGFR4(FGF19的受体)的有效、选择性小分子抑制剂。一项在晚期肝细胞癌患者中开展的评估BLU-554的安全性和初步临床活性的I期临床研究中,98例患者的疗效可评价,其中66例患者为经IHC检测为FGF19表达阳性。FGF19阳性患者的ORR 为17%(11 of 66),包括1例完全缓解和10例部分缓解,而在FGF19阴性或未知患者中未观察到缓解[7],提示BLU-554对FGF19阳性的肝细胞癌患者具有抗肿瘤活性。
Bemarituzumab(Bema)是FGFR2b的首个人源化IgG1抗体;2021年FDA基于FIGHT研究的结果授予其突破性疗法认定,用于联合FOLFOX6一线治疗FGFR2b过表达的HER2阴性的局部晚期或转移性胃癌或胃-食管交界处癌患者。FIGHT研究是一项II期全球多中心随机双盲安慰剂对照研究(NCT03694522),共纳入了155例FGFR2b过表达的HER2阴性的局部晚期或转移性胃癌或胃-食管交界处癌患者。最新结果显示与FOLFOX6化疗组相比,Bema联合FOLFOX6延长了患者的mPFS(9.5个月vs 7.4个月,HR=0.68,P=0.073),尽管差异并不显著[8];目前已经开展后续III期研究。
作为新一代液态活检精准医疗国际领军企业——慧渡医疗,针对外周血开发的靶向用药和MRD检测产品,具有灵敏度高和样本量要求低的优势。慧渡医疗系列基因检测产品获得国际最权威的美国FDA突破性医疗器械(BDD)认定(点击查看原文)、欧盟CE认证和英国UKCA认证(点击查看原文),这是国际权威监管机构对慧渡医疗技术、产品和其临床应用价值的认可。慧渡医疗新一代液态活检系列产品正被应用于全球排名前10的顶尖药企、美国哈佛大学等国际顶级学术机构开展的众多临床研究,推动国内、国际药企合作伙伴国际多中心临床试验、全球CDx伴随诊断开发和临床诊疗。

2021年,泌尿科国际著名专业期刊THE JOURNAL OF UROLOGY 以封面论文的形式发表了慧渡医疗与上海交通大学附属仁济医院陈海戈教授团队的一项重要研究成果,证明慧渡医疗基于尿液样本的液态活检可以用于膀胱癌患者的基因诊断,检测结果与肿瘤组织金标准高度一致,并可以检测包括FGFR、PIK3CA等重要致病基因的变异(包括基因扩增、点突变和融合)(点击查看原文)。这一研究成果为新一代液态活检助力靶向新药研发、临床试验和临床应用提供了强有力的证明,为加速FGFR靶向药物研究和造福患者提供了坚实的基础。
参考文献:
[1] Zheng J, Zhang W, Li L, He Y, Wei Y, Dang Y, Nie S, Guo Z. Signaling Pathway and Small-Molecule Drug Discovery of FGFR: A Comprehensive Review. Front Chem. 2022 Apr 14;10:860985. [2] Helsten T, Elkin S, Arthur E, et al. The FGFR Landscape in Cancer: Analysis of 4,853 Tumors by Next-Generation Sequencing. Clin Cancer Res. 2016 Jan 1;22(1):259-67. [3] Siefker-Radtke AO, Necchi A, Park SH, et al. Efficacy and safety of erdafitinib in patients with locally advanced or metastatic urothelial carcinoma: long-term follow-up of a phase 2 study. Lancet Oncol. 2022 Feb;23(2):248-258. [4] Nogova L, Sequist LV, Perez Garcia JM, et al. Evaluation of BGJ398, a Fibroblast Growth Factor Receptor 1-3 Kinase Inhibitor, in Patients With Advanced Solid Tumors Harboring Genetic Alterations in Fibroblast Growth Factor Receptors: Results of a Global Phase I, Dose-Escalation and Dose-Expansion Study. J Clin Oncol. 2019 Feb 1;37(4):358. [5] Aggarwal C, Redman MW, Lara PN Jr, et al. SWOG S1400D (NCT02965378), a Phase II Study of the Fibroblast Growth Factor Receptor Inhibitor AZD4547 in Previously Treated Patients With Fibroblast Growth Factor Pathway-Activated Stage IV Squamous Cell Lung Cancer (Lung-MAP Substudy). J Thorac Oncol. 2019 Oct;14(10):1847-1852. [6] Chae YK, Hong F, Vaklavas C, et al. Phase II Study of AZD4547 in Patients With Tumors Harboring Aberrations in the FGFR Pathway: Results From the NCI-MATCH Trial (EAY131) Subprotocol W. J Clin Oncol. 2020 Jul 20;38(21):2407-2417. [7] Kim RD, Sarker D, Meyer T, et al. First-in-Human Phase I Study of Fisogatinib (BLU-554) Validates Aberrant FGF19 Signaling as a Driver Event in Hepatocellular Carcinoma. Cancer Discov. 2019 Dec;9(12):1696-1707. [8] Wainberg ZA, Enzinger PC, Kang YK, et al. Bemarituzumab in patients with FGFR2b-selected gastric or gastro-oesophageal junction adenocarcinoma (FIGHT): a randomised, double-blind, placebo-controlled, phase 2 study. Lancet Oncol. 2022 Nov;23(11):1430-1440.