除了肺癌,KRAS突变也常常发生于其他实体瘤。在胰腺癌中,KRAS的突变频率高达90%,其中G12D和G12V突变约占80%[1];在结直肠癌中,KRAS的突变频率在40%左右,以KRAS G12D突变最常见[2,3]。Sotorasib是第一个正式获批的KRAS G12C抑制剂,用于既往至少接受过一线系统治疗的KRAS G12C突变阳性的局部晚期或转移性成年NSCLC患者;目前在其他KRAS G12C突变阳性的实体瘤中开展的KRAS G12C抑制剂的临床研究也有了一些初步的疗效和安全性结果。
1. Sotorasib(AMG510)
CodeBreaK 101(NCT04185883)是一项评估sotorasib联合panitumumab的疗效和安全性的1b/2期临床研究,研究入组化疗失败且携带KRAS G12C突变的转移性CRC患者。截至2022年1月28日,CodeBreaK 101研究共纳入40例患者,经确认的客观缓解率(ORR)为30%,疾病控制率(DCR)为90%。在92.5%的患者中观察到治疗相关的不良反应(TRAEs),3级TRAEs的发生率为22.5%,没有3级以上TRAEs或因TRAEs导致的停药[4]。
sotorasib的另一项CodeBreaK 100研究(NCT03600883)纳入了38例携带KRAS G12C突变的经治胰腺癌患者(截至2021年11月1日)。其中8例患者经确认为部分缓解,ORR为21.1%、DCR为84.2%。TRAEs发生率为84.2%,在6例患者中观察到≥3TRAEs,无因TRAEs导致的死亡或停药[5]。
2.Adagrasib(MRTX849)
Adagrasib(MRTX849)是一种高效的、选择性KRAS G12C共价抑制剂。KRYSTAL-1(NCT03785249)是一项在携带KRAS G12C突变的晚期实体瘤中开展的评估adagrasib单药和联合用药的疗效和安全性的I/II期临床研究。截至2022年6月16日,44例和32例经多线治疗(中位线数=3)的CRC患者分别接受adagrasib单药治疗和adagrasib联合西妥昔单抗治疗。在43例疗效可评估的单药治疗组患者中,ORR为19% (8/43)、DCR为86% (37/43)。中位缓解持续时间(DOR)为4.3个月、中位 PFS 5.6个月。1-2级不良事件(AEs)和3-4级AEs发生率分别为59%和34%。在28例疗效可评估的联合治疗患者中,ORR为46%(13/28)、DCR为100%(28/28)。中位DOR为7.6个月、PFS为6.9个月。1-2级AEs和3-4级AEs发生率分别为84%和16%。联合治疗的疗效明显优于单药,联合治疗组的1-2级AEs发生率高于单药组[6]。
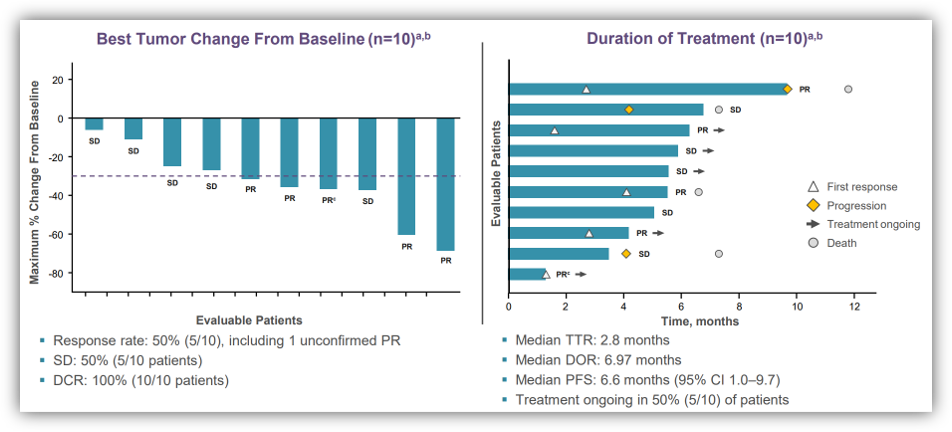
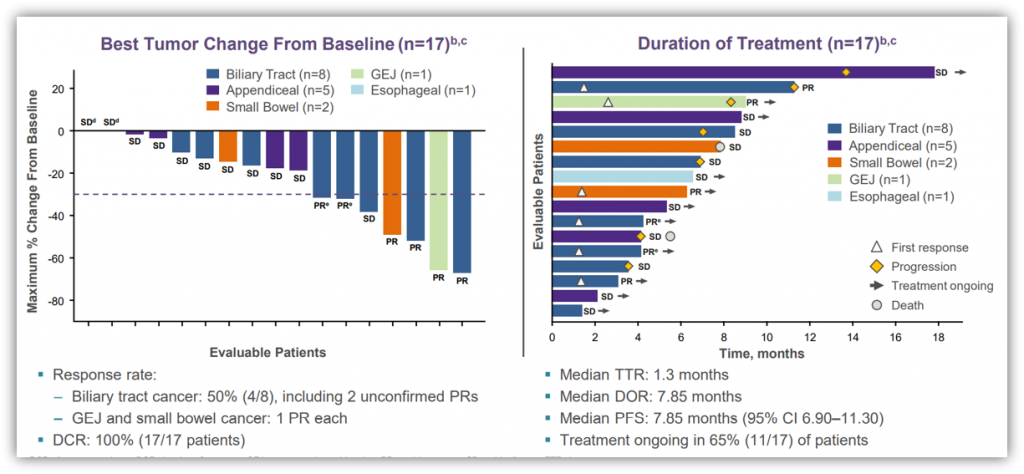
此外,该研究还纳入了30例接受adagrasib单药治疗的KRAS G12C突变的胃肠道肿瘤患者(截至2021年9月10日),包括12 PDAC、8例胆道肿瘤、5例阑尾癌、2例胃-食管癌、2例小肠癌和1例食管癌。在27例疗效可评估的患者中,11例患者疗效为PR(41%)、DCR为100%(27/27)。在12例PDAC患者,10例患者的疗效可评估,其中5例患者为PR、DCR为100%(10/10);中位PFS为6.6个月,仍有一半患者在治疗中。在17例疗效可评估的其他GI患者中,6例患者为PR、DCR为100%。总的AEs发生率为91% (38/42),最常见的AEs为恶心、腹泻、呕吐和乏力;3/4级AEs的发生率为21%,未观察到5级AEs[7]。
3. GDC-6036
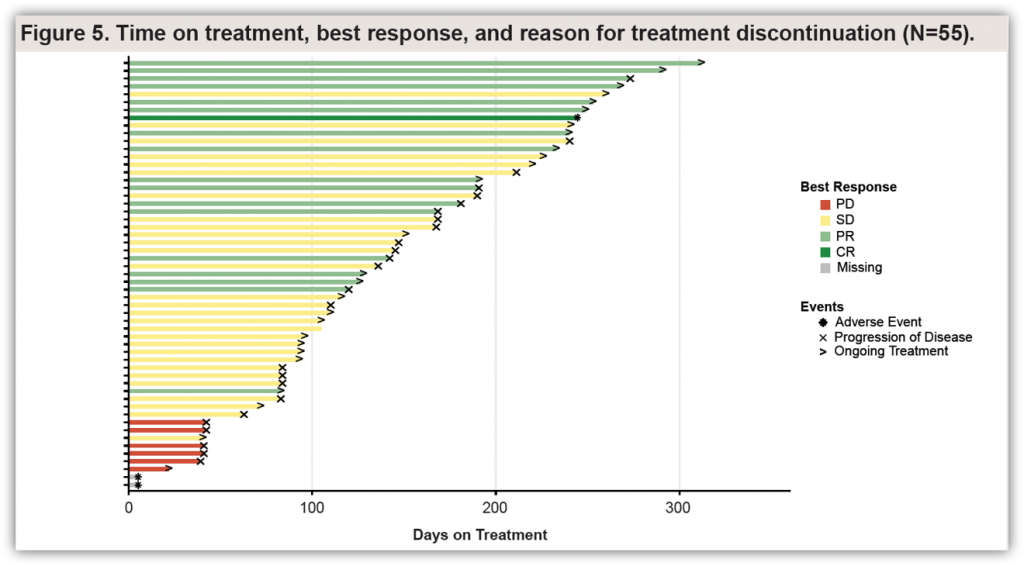
截至2022年1月28日,NCT04449874还纳入了14例NSCLC和CRC以外的其他实体瘤患者,包括4例胆管癌、胰腺癌、以及肛门癌、阑尾癌、乳腺癌、十二指肠癌、子宫内膜癌、肺神经内分泌癌和胃癌各一例。经确认的ORR为14%(2/14)。最常见的AEs包括恶心、呕吐、腹泻和肝功能异常[9]。
国际领先的液态活检基因检测公司——慧渡医疗,自主开发的PredicineBEACON™是一款可以不受限于肿瘤组织、采用血浆或尿液作为基线样本,实现个性化MRD检测的MRD检测产品,并且已经被证实在接受PD-1抑制剂toripalimab新辅助免疫治疗的非肌层浸润性膀胱癌患者表现出优秀的预测疗效和复发的性能(点击查看原文)。PredicineBEACON™目前被多家国际顶尖药企和医院采用,广泛应用于全球新药临床试验和个体化MRD疾病的复发监控。
慧渡医疗新一代液态活检系列产品正在应用于位居世界500强的全球排名前十的国际顶尖药企和美国哈佛大学等国际顶级学术机构开展的众多临床研究,为ctDNA液态活检应用于药物临床试验并且服务全球肿瘤患者打下了坚实的基础。
参考文献:
[1] Yang Y, Ding Y, Gong Y, Zhao S, Li M, Li X, Song G, Zhai B, Liu J, Shao Y, Zhu L, Pang J, Ma Y, Ou Q, Wu X, Zhang Z. The genetic landscape of pancreatic head ductal adenocarcinoma in China and prognosis stratification. BMC Cancer. 2022 Feb 18;22(1):186. [2] Yuan Y, Liu Y, Wu Y, Zhang J, et al. Clinical characteristics and prognostic value of the KRAS mutation in Chinese colorectal cancer patients. Int J Biol Markers. 2021 Jun;36(2):33-39. [3] Biller LH, Schrag D. Diagnosis and Treatment of Metastatic Colorectal Cancer: A Review. JAMA. 2021 Feb 16;325(7):669-685. [4] Annals of Oncology (2022) 33 (suppl_7): S136-S196. 10.1016/annonc/annonc1048 [5] JCO.2022.40.36_suppl.360490 Journal of Clinical Oncology 40, no. 36_suppl (October 20, 2022) 360490-360490. [6] Annals of Oncology (2022) 33 (suppl_7): S136-S196. 10.1016/annonc/annonc1048 [7] Bekaii-Saab TS, Spira AI, Yaeger R, et al. KRYSTAL-1: Updated activity and safety of adagrasib (MRTX849) in patients (pts) with unresectable or metastatic pancreatic cancer (PDAC) and other gastrointestinal (GI) tumors harboring a KRASG12C mutation. Abstract#519, JCO.2022.40.4_suppl.519. [8] Annals of Oncology (2022) 33 (suppl_7): S136-S196. 10.1016/annonc/annonc1048 [9] Annals of Oncology (2022) 33 (suppl_7): S197-S224. 10.1016/annonc/annonc1049